L'electròlit és una part essencial d'una bateria. Sense aquest fluid, simplement no funcionarà. En aquest article, explicarem què és, com afegir-lo, quina hauria de ser la seva gravetat específica i també proporcionarem algunes taules útils.
- Propietats i característiques dels electròlits
- Què és l'àcid sulfúric per a una bateria?
- Aigua destil·lada per a bateries
- Preparació d'electròlits per a bateries
- Propietats bàsiques de l'electròlit d'àcid sulfúric
- Propietat de viscositat
- Resistència específica de l'electròlit
- electròlits alcalins
- Vida útil dels electròlits
- Com comprovar l'electròlit en una bateria de cotxe?
Propietats i característiques dels electròlits
L'electròlit de la bateria és una barreja d'aigua destil·lada i àcid sulfúric.
Què és l'àcid sulfúric per a una bateria?
En aparença, s'assembla a una substància oliosa amb un pes significatiu. No té olor i es dissol perfectament en aigua. Durant la producció d'electròlits per a bateries de plom-àcid, es pot observar calor. Aquest efecte és responsable de la dissolució de l'àcid.
Els conductors utilitzen l'àcid estàndard GOST 667-83 de grau A per a les seves bateries. L'àcid d'alta puresa, GOST 142b2-78, també està disponible a les botigues. Normalment té les característiques següents:
- Monohidrat 92-94%.
- Densitat segons la norma 1.830 g/cm3.
- Impureses fins a un 0,03665% (ferro 0,012%, òxids de nitrogen 0,0001%, manganès fins a un 0,0001%, clor - 0,0005%, arsènic - 0,0001%).
Aigua destil·lada per a bateries
Sense aquesta aigua, és simplement impossible crear un electròlit d'alta qualitat. Està prohibit utilitzar H₂ com a substitut.2No es permet l'aigua d'un riu, d'un subministrament d'aigua o d'una aixeta, inclosa l'aigua industrial i potable. Es permet el condensat de vapor. Tanmateix, cal una anàlisi química abans del seu ús. Durant aquest procés, s'ha de determinar el nivell de ferro, que no ha de superar el 0,0004%. Els nivells de coure tampoc han de ser superiors al 0,005%.
Els destil·ladors electrònics s'utilitzen per obtenir el líquid tan cobejat a farmàcies, fàbriques, hospitals i laboratoris. Aquests dispositius també estan disponibles per al consumidor mitjà. L'aigua destil·lada es pot obtenir mitjançant dispositius com el destil·lador HR-01, l'alambic de columna Wein, el Pervach Econom i altres.
Hauries de provar l'aigua produïda pel teu destil·lador cada 6 mesos. Assegura't que els nivells de sòlids siguin els següents:
- Calci – 1,0 mg.
- Amoníac: 5 mg per litre.
- Sulfats: fins a 0,5 g/l.
- Amoni no més de 0,05 mg/l.
- Clorur no superior a 0,02 mg/l.
A més, l'aigua destil·lada s'ha de provar per detectar nitrats, ferro i metalls pesants. La taula resultant ha d'indicar si aquesta aigua es pot utilitzar per crear electròlits. Ha de complir amb la norma GOST 6709-72.
En els punts de venda habituals, es pot comprar una ampolla d'aigua d'1,5 litres per 20-30 rubles.
Preparació d'electròlits per a bateries
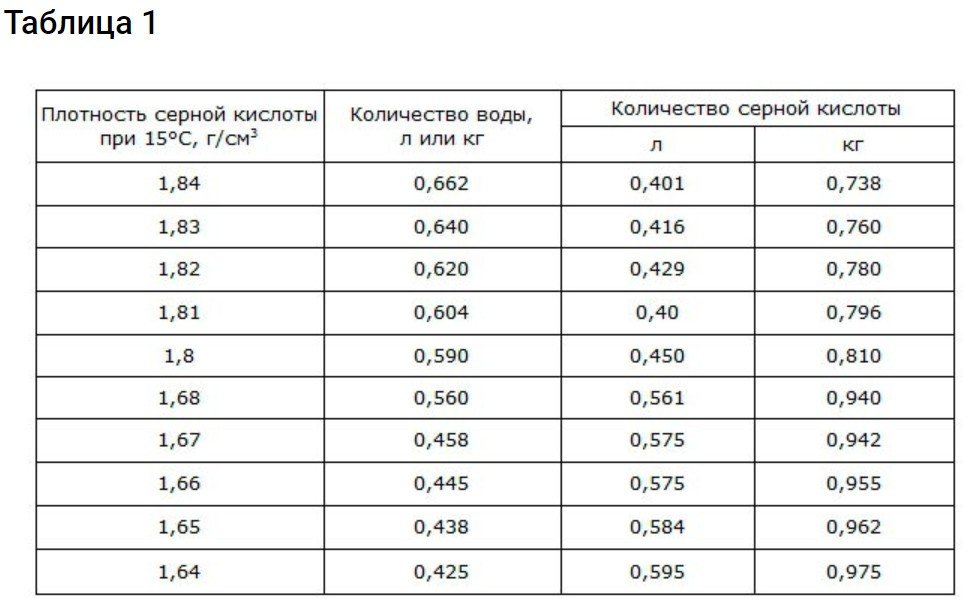
L'electròlit de la bateria és essencialment una solució aquosa d'H₂2Així doncs4Feu servir aigua i àcid amb els paràmetres descrits anteriorment. Per omplir i completar, feu servir un electròlit amb una densitat d'1,18-1,24 g/cm³. És possible que utilitzeu una densitat d'1,83 g/cm³.3 aleshores dividiu el procés en dos enfocaments:
- Primer creeu un electròlit d'1,4 g/cm3Espereu fins que la temperatura baixi a 20 graus Celsius.
- A continuació, prepareu l'electròlit necessari a partir d'aquest electròlit.
Aquest mètode evitarà que l'àcid sulfúric s'escalfi massa.
L'electròlit s'ha de preparar en un recipient especialitzat. Pot ser de plàstic, terrissa o ebonita. Plom capacitatAixò també funcionarà. Però no facis servir mai un bol de vidre. S'esquerdarà a causa de les altes temperatures.
El primer que heu de fer és abocar-hi un cert nivell d'H₂ destil·lat.2O. Després d'això, aboqueu-hi el volum necessari d'àcid sulfúric en un raig fi. Remeneu la barreja constantment amb una vareta de vidre. És millor si H2Així doncs4 Ho afegiràs a porcions.
Aboqueu sempre àcid a l'aigua. En cas contrari, acabareu amb un còctel de gotes d'àcid perilloses que esquitxaran en totes direccions. Això podria causar cremades al cos i danyar els objectes propers.
Equip de protecció per a la feina:
- Botes de goma.
- Guants fets del mateix material.
- Granotes de tela especials.
- Ulleres per a la protecció.
- Davantal engomat.
A continuació trobareu taules especials a partir de les quals podeu entendre quines proporcions s'han d'observar.
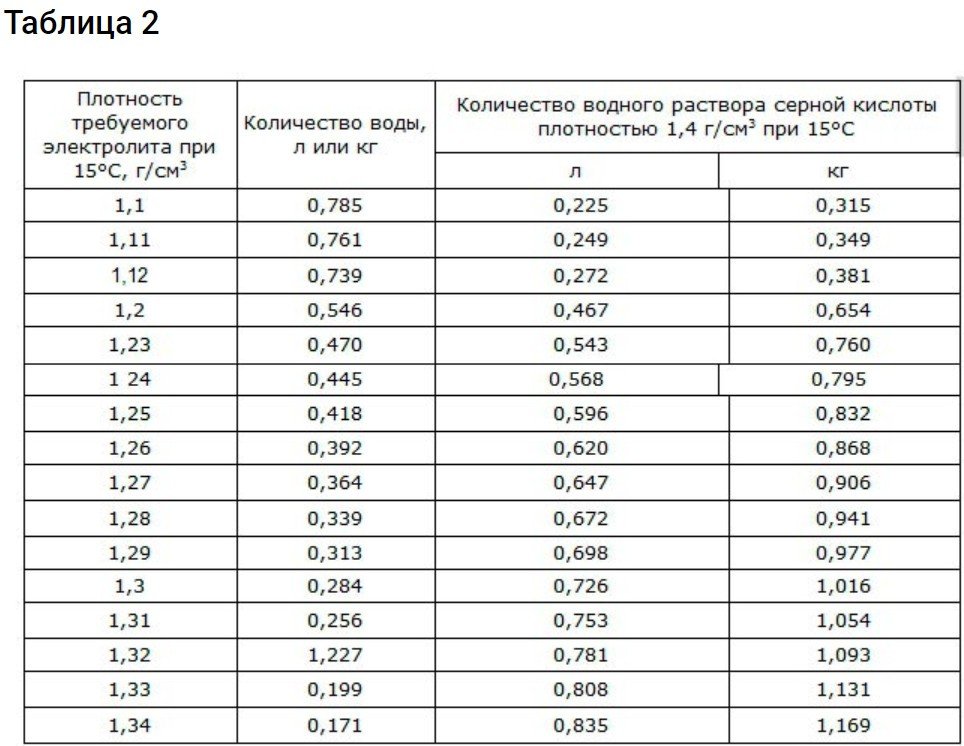
Dades sobre la proporció d'àcid sulfúric i aigua destil·lada
Per obtenir una densitat d'1,4 g/cm3 Cal que us cenyiu a les dades de la segona taula.
Per obtenir una densitat d'1,83 g/cm3 Utilitzeu la informació que es proporciona a continuació.
S'ha d'utilitzar un hidròmetre per obtenir informació sobre la densitat. Quan es mesura la temperatura, el termòmetre no ha de contenir fusta ni metall. Les mesures s'han de prendre quan la temperatura baixi a 20 graus.
El gradient de temperatura-densitat correspon a un valor de 0,0007 g/cm³ per 1 °C. Si la temperatura és superior a 20 °C, s'afegeix una correcció en els càlculs a les dades de densitat mesurades. Diguem que la temperatura real és de 30 °C i la nostra és de 20 °C. Aleshores la diferència serà de 10 °C.0Així doncs, això és el que obtenim: 0,0007 x 10 = 0,07 g/cm3. És a dir, afegim un error de 0,007 g/cm3 a les dades de densitat que hem obtingut.
Si la temperatura real és de 10 graus, la diferència amb la temperatura indicada anteriorment serà de 10 C.00,0007 g/cm3 es multiplica per deu i la correcció és de 0,007 g/cm3. En aquest cas, la correcció es resta de la densitat mesurada a t = 10 °C.0.
Està prohibit omplir l'electròlit més de 25 C.0.
Propietats bàsiques de l'electròlit d'àcid sulfúric
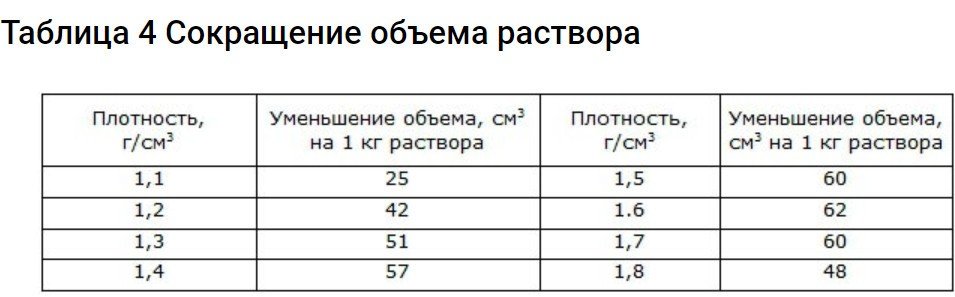
A més de l'anterior, cal tenir en compte un altre factor. Si es pren el mateix volum d'àcid i aigua, el volum resultant després de la barreja serà significativament menor. Per tant, aquest paràmetre també s'ha de tenir en compte a l'hora de preparar l'electròlit. Per fer-ho, utilitzeu les dades de la taula.
Propietat de viscositat
Afecta el rendiment de les bateries amb plaques de plom. El procés a les bateries és difusional. La velocitat d'aquesta difusió depèn de la viscositat. Aquesta viscositat determina la rapidesa amb què l'electròlit arriba a la superfície i als porus dels elèctrodes durant la descàrrega.
Si la viscositat augmenta, la difusió s'alentirà. Quan la temperatura baixa 25 graus, la viscositat es duplica. A 50 °C0 el seu augment es produeix 30 vegades en comparació amb la t normal.
Quan la viscositat augmenta, aleshores capacitat de la bateriadisminueix. A causa d'això, el rendiment de les bateries de plom-àcid en temps fred disminueix. Això s'ha de tenir en compte a l'hora d'instal·lar bateries de gel.
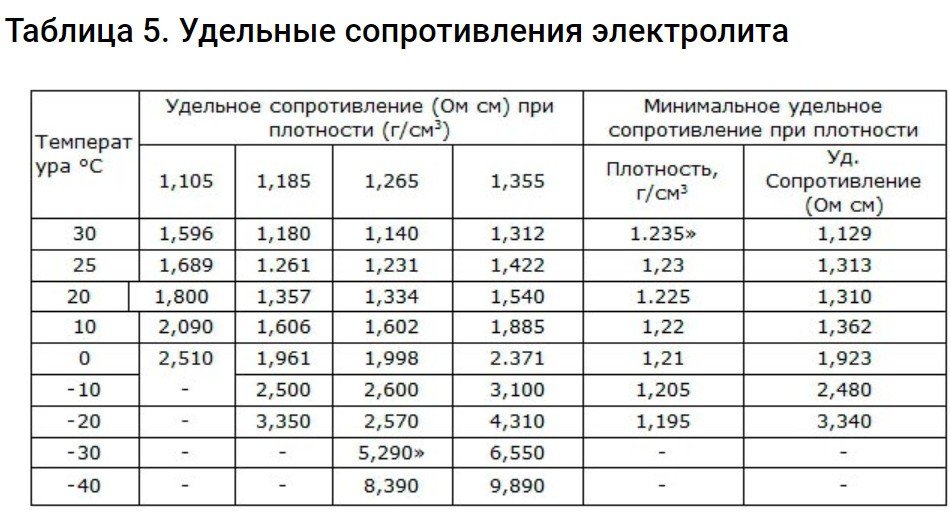
Resistència específica de l'electròlit
Per calcular-ho, haureu de recórrer a la fórmula =rS/L. És rellevant quan la resistència de l'electròlit que ocupa capacitat, limitada a una longitud d'1 centímetre i una secció transversal d'1 cm3El significat de les lletres de la fórmula:
- L – longitud.
- r – resistència específica en ohms cm.
- S – secció transversal cm2.
R canvia en el moment en què canvien la temperatura i la concentració de l'electròlit. resistència internaSi la bateria és petita, hauríeu d'utilitzar un electròlit amb la R específica més baixa.
Els paràmetres d'aquestes resistències es troben en aquesta taula.
R augmenta a mesura que la temperatura disminueix, especialment per sota de zero graus.
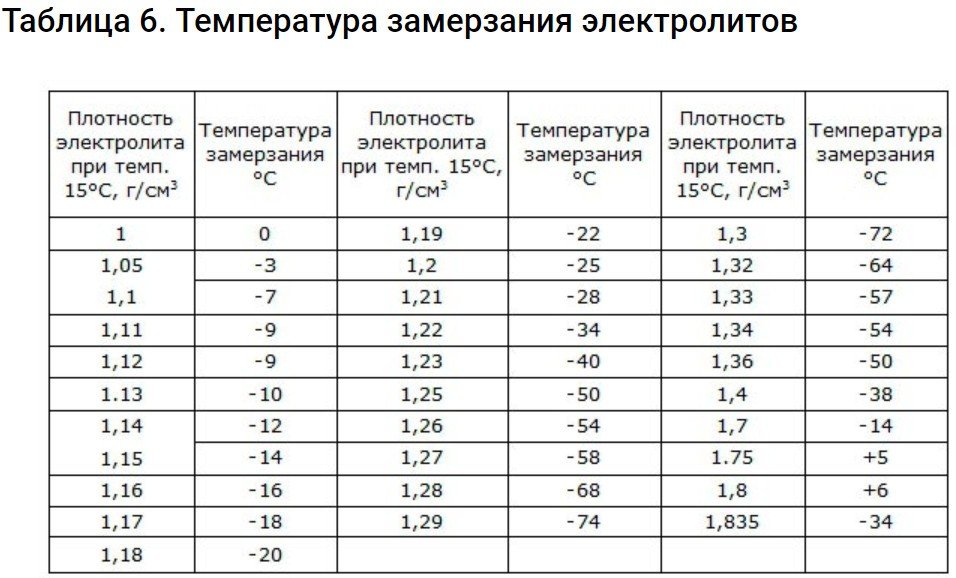
De fet, el punt de congelació de l'electròlit és un indicador important. A mesura que la bateria es descarrega, la seva densitat i el seu punt de congelació disminueixen. A temperatures baixes, el volum del líquid augmenta, cosa que provoca danys als elèctrodes i a la mateixa bateria.
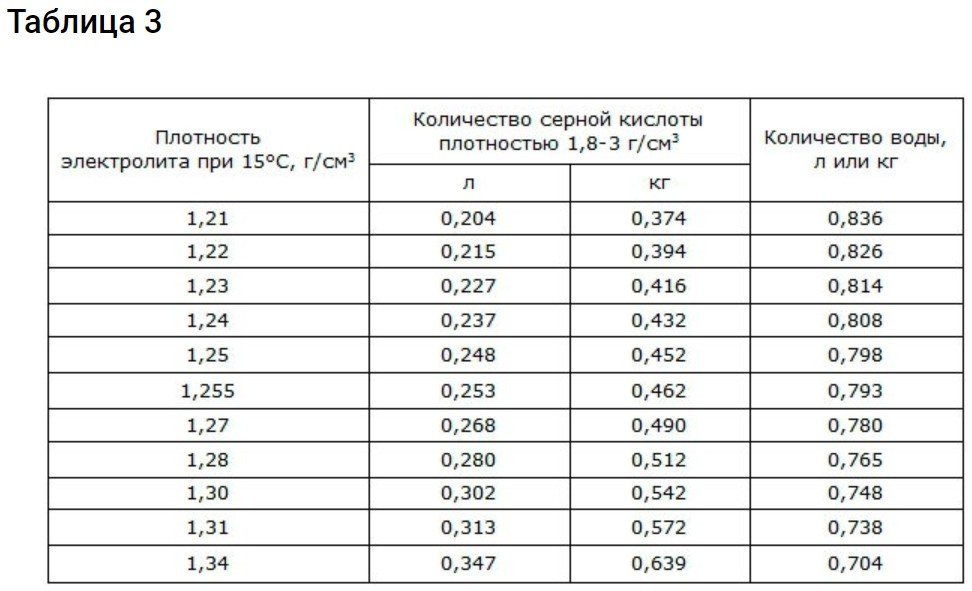
Electròlit amb una densitat d'1,29 g/cm3 té el punt de congelació més baix.
Les bateries d'arrencada utilitzades en condicions de fred tenen una densitat d'1,26-1,30 g/cm2Aquest electròlit no es congela ni tan sols en el clima més fred.
La taula següent mostra els nivells de densitat als quals es produeix la congelació.
electròlits alcalins
El liti i el potassi s'utilitzen per crear-los; tots dos són càustics.
La potassa càustica, o KOH per abreujar, és blanca, sòlida i altament soluble en H₂2A. S'allibera calor quan es dissol. Segons la norma GOST, aquesta substància es produeix en quatre graus:
- Més alt.
- A
- Tipus B.
- Jet.
El primer grau conté fins a un 96% de potassa càustica. El segon grau, "A", conté fins a un 92%. El tercer grau, "B", conté un 88%. El quart grau té menys impureses que el grau tècnic.
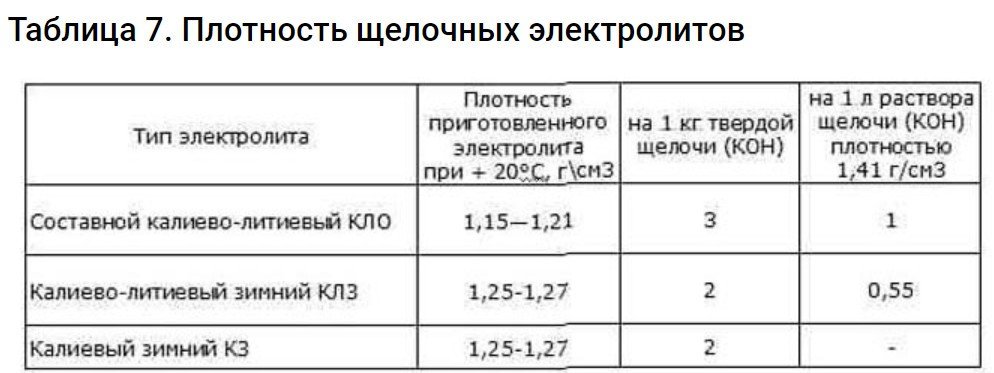
Quan creeu un electròlit a partir de liti i potassi, primer dissoleu el potassi i després afegiu-hi el liti. Això es fa a una velocitat de 10-20 grams per cada litre d'electròlit. Després d'això, deixeu-ho reposar durant 15-20 hores. Això permet que la temperatura baixi i que les impureses precipitin. Abans de deixar la solució, tapeu-la hermèticament amb una tapa.
La solució líquida resultant s'ha d'abocar en un recipient net. A continuació, comproveu la gravetat específica amb un hidròmetre. Si cal, ajusteu la gravetat específica al nivell correcte. Després d'això, afegiu àlcali i aigua. Alternativament, podeu afegir un electròlit concentrat ja preparat.
Quina densitat requereix la teva bateria? Pots trobar aquesta informació a la documentació tècnica. Si la documentació no conté cap recomanació crítica, es pot utilitzar un electròlit d'1,19-1,21 g/cm3.3 a 15 graus Celsius. També hauria de contenir entre 10 i 20 g/l de Li.
És important tenir en compte que un fluid amb aquestes característiques s'utilitza millor a temperatures no inferiors a 20 graus Celsius. A temperatures més baixes, és adequada una densitat d'1,25–1,27 g/cm3.3Però sense l'ús de Li càustic.
Per revitalitzar les bateries de ferro-níquel i alcalines de cadmi-níquel, s'utilitza un electròlit a base de liti i potassi amb una densitat d'1,255-1,279 g/cm3.3A tot això, encara cal afegir 69 grams de Li càustic per 1 litre d'electròlit.
Per facilitar la preparació, feu servir la taula.
Vida útil dels electròlits
Es pot emmagatzemar indefinidament. Per evitar precipitacions, mantingueu-lo allunyat de la llum solar directa. A més, eviteu les fluctuacions de temperatura. La vida útil real de l'electròlit de la bateria és desconeguda, ja que es veu afectada per molts factors.
Com comprovar l'electròlit en una bateria de cotxe?
La revisió s'ha de fer dues vegades cada 12 mesos: abans de l'hivern i a principis d'estiu.
Eines per dur a terme aquest procediment:
- Hidròmetre: permet mesurar la densitat.
- Tub de vidre amb un diàmetre de 5-7 mm.
Algoritme de verificació:
- Traieu la bateria del cotxe.
- Desenrosqueu tots els taps.
- Col·loqueu l'hidròmetre amb l'extrem de treball en una secció.
- Utilitzant la bombeta del dispositiu, aspireu l'electròlit fins que el flotador pugi i comenci a surar sense tocar les parets de l'hidròmetre.
- La densitat es pot veure en el punt on la vareta i l'electròlit es toquen.
- Anoteu la informació rebuda en un full de paper.
Cal repetir un procediment similar amb cada banc de bateries.
Avui en dia, poca gent fa servir electròlit de bateria casolà. Només cal que visiteu qualsevol botiga i compreu la substància necessària per un petit preu. Això us estalviarà temps i us protegirà la vida!