L'ús generalitzat de petits electrodomèstics per part dels consumidors implica la necessitat de fonts d'alimentació o circuits d'alimentació única cèl·lules galvàniques, comunament conegudes com a piles. Van aparèixer per primera vegada l'any 1800, gràcies al físic italià Alessandro Volta. Varien en mida i forma, voltatge, capacitat i tipus de pila. Les piles alcalines i salines s'utilitzen àmpliament en el mercat dels petits electrodomèstics i l'electrònica.
Què són les piles salines?
Bateries de sal — fonts de corrent elèctric generades en un dispositiu simple mitjançant una reacció química. De vegades s'anomenen bateries de carboni-zinc o bateries de carboni. Aquest tipus de cel·la es considera la més barata, però té una baixa densitat d'energia, cosa que la fa molt adequada per a dispositius de baixa potència. En dispositius amb un consum d'energia elevat o amb pujades característiques del corrent de càrrega i la temperatura, no duren gaire i, per tant, no s'utilitzen.
Designació de bateries de sal
La designació de les bateries salines s'accepta segons diverses normes:
- Sistema de classificació americà.
- Sistema Internacional (CEI).
- Estàndard interestatal (GOST).
| Sistema de classificació americà | Classificació Internacional IEC | GOST | Mida, mm | Capacitat, mAh |
| A | R23 | 17x50 | ||
| AA | R6 | 316 | 14,5x50,5 | 1100 |
| AAA | R03 | 286 | 10,5x44,5 | 540 |
| C. | R14 | 343 | 26,2x50 | 3800 |
| D | R20 | 373 | 34,2x61,5 | 8000 |
| F | R25 | 33x91 | ||
| 1/2AA | 14.250 rands | 312 | 14,5x25 | 250 |
| R10 | R10 | 332 | 21,5x37,3 | 1800 |
Per exemple, el marcatge d'una bateria salina R 6 significa: rodona, cilíndrica, dit, element tipus sal, dimensions totals 14,5x50,5, capacitat1100 mAh. El voltatge estàndard és d'1,5 V. La designació "R" (sal) a l'etiqueta de la bateria distingeix les bateries salines d'altres tipus de bateries (alcalines o de liti).
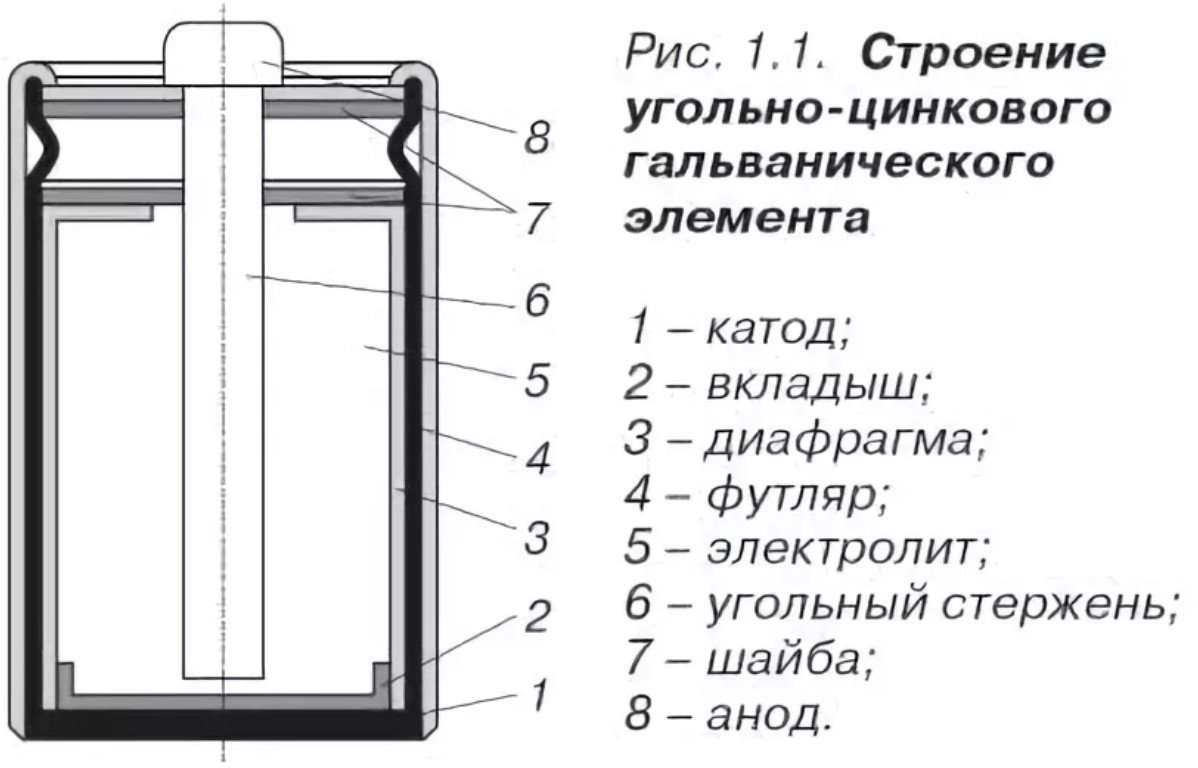
Disseny i composició
El disseny d'una bateria de sal és força senzill i consisteix en:
- Càtode - el mateix la carcassa de la bateria de sal està feta fet de zinc, amb propietats anticorrosió millorades i un alt grau de purificació (menys).
- L'ànode és un aglomerat, fabricat per premsatge, impregnat amb electròlit (plus).
- Electròlit: clorur d'amoni o clorur de zinc, amb l'addició d'un espessidor (midó).
- Conductor de corrent de carboni: passa pel centre, tractat amb composició de parafina.
- Cambra de gas: situada a la part superior, dissenyada per recollir els gasos de la reacció química.
- Junta: situada a la part superior, actua com a segellador.
- Estoig protector: cartró o llauna per protegir contra la corrosió i les fuites d'electròlits.
Considerem la composició d'una bateria salina des d'un punt de vista químic:
- El càtode és de zinc altament purificat, resistent a la corrosió.
- Barreja ànode - MnO2, grafit, impregnació d'electròlits.
- L'electròlit és clorur d'amoni o una barreja de clorur de zinc amb clorur de calci.
Quines piles són millors: les salines (1) o les alcalines (2)?
La comparació es pot fer en forma de taula, on es vegin clarament els avantatges i els inconvenients dels diferents tipus d'elements:
| Paràmetres de comparació | 1 | 2 |
| Condicions de temperatura, condicions de funcionament | El rendiment es redueix a baixes temperatures i no pot suportar sobretensions. | Funciona bé a baixes temperatures, fins a -20O, suporten fàcilment les sobretensions, no tenen por d'un augment brusc del corrent de càrrega |
| Data de caducitat | 2-3 anys | 5 anys |
| Aplicació | Apte per a ús en dispositius amb baix consum de corrent | Apte per a ús en equips amb consum energètic mitjà i alt |
| Instruments, dispositius tècnics | Rellotges despertadors, rellotges de paret, comandaments a distància, mini llanternes, joguines senzilles | Reproductors, llanternes, joguines musicals, gravadores de veu, monitors de pressió arterial |
A l'hora d'escollir una font d'alimentació per a un dispositiu amb requisits de funcionament específics, és important saber distingir entre una pila salina i una pila alcalina. Mentre que les piles salines estan marcades amb la lletra R, les piles alcalines van precedides de la lletra L (LR).
Conclusions i recomanacions
Aquest tipus de font d'alimentació és més lleugera i més assequible. Tanmateix, la vida útil de les bateries salines és curta (de 2 a 3 anys) i poden autodescarregar-se parcialment durant l'emmagatzematge i durant l'ús, durant una pujada de corrent sobtada. Per tant, donat el seu rendiment relativament deficient però el seu cost relativament baix, és fàcil comprar diversos jocs de bateries com a còpia de seguretat.
No alt capacitatles bateries de sal (2-3 vegades menys que altres tipus) limiten el seu ús a dispositius senzills amb baix corrent de càrrega.
És fàcil determinar si és possible carregar bateries salines: el nom de la bateria s'indica a la carcassa del dispositiu destinat a la càrrega. capacitatEn mAh. Si aquest valor no està disponible, és una bateria normal i, malgrat els nombrosos consells d'experts, no s'hauria de carregar. Carregar-la no proporcionarà l'efecte esperat a llarg termini i podria provocar un accident a causa d'un sobreescalfament i fuites d'electròlits. Si necessiteu una font d'alimentació més fiable i duradora, és millor invertir en una alternativa alcalina o una bateria recarregable.
Dada interessant: Bateria de sal DIY Es pot fer de manera molt senzilla. Necessitareu monedes de 50 kopecks, paper d'alumini, paper i una solució salina. El millor és submergir les monedes en una solució de vinagre abans d'utilitzar-les per eliminar qualsevol placa o brutícia. Munteu el dispositiu: una moneda, paper submergit en la solució salina i paper d'alumini. Repetiu aquest procés diverses vegades, creant una columna amb la moneda (positiva) a un extrem i el paper d'alumini (negatiu) a l'altre. El corrent es genera per la diferència de potencial creada per l'electròlit (solució salina) entre el metall del paper d'alumini i la moneda. Aquest invent s'anomena pila voltaica, i el seu voltatge depèn directament del nombre de monedes utilitzades: com més monedes hi hagi, més alt serà el voltatge obtingut. Tanmateix, després de l'experiment, les monedes ja no es poden utilitzar; tindran un recobriment rovellat.