La primera cel·la galvànica del món va ser desenvolupada per Luigi Galvani. Llegiu sobre la seva història. en aquest articleEssencialment, és una font temporal de corrent elèctric generada per una reacció química. El flux d'electrons es genera per la interacció entre dos metalls diferents. Com a resultat, l'energia química es converteix en energia elèctrica, que després es pot utilitzar en la vida quotidiana.
Una cel·la galvànica de concentració és una font de corrent que consisteix en dos elèctrodes metàl·lics idèntics col·locats en una barreja de sals d'aquest metall en diverses concentracions.
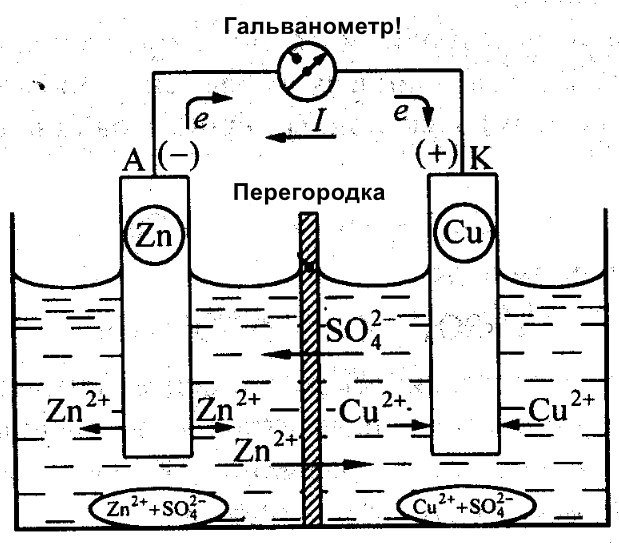
A més de Galvani, Daniel Jacobi també va treballar en la creació d'una bateria eficient. Va modificar lleugerament la seva font d'energia. Consisteix en una placa de coure col·locada en CuSO4 i una placa de zinc immersa en ZnSO4. Per evitar que interactuïn directament, es col·loca una paret porosa entre elles. A continuació es mostra un diagrama de la cel·la galvànica de Daniel Jacobi.
El zinc i el coure tenen una reactivitat diferent i, per tant, la seva càrrega serà diferent. Com a resultat, els nivells dels elèctrodes tampoc són uniformes. Això els permet moure's i generar un corrent elèctric o galvànic. Aquest corrent comença a fluir quan una persona o l'inventor d'un dispositiu d'emmagatzematge de corrent connecta una càrrega. Aquesta càrrega pot ser una bombeta, una ràdio, un ratolí d'ordinador o altres dispositius elèctrics.
Diagrama esquemàtic d'una cel·la galvànica
Un diagrama de circuit fa referència a la seva composició i estructura. Es pot construir a partir de diversos elements químics utilitzant dispositius auxiliars. A continuació, es descriurà breument l'estructura d'una cel·la galvànica. Llegiu-ne més en aquest article.!
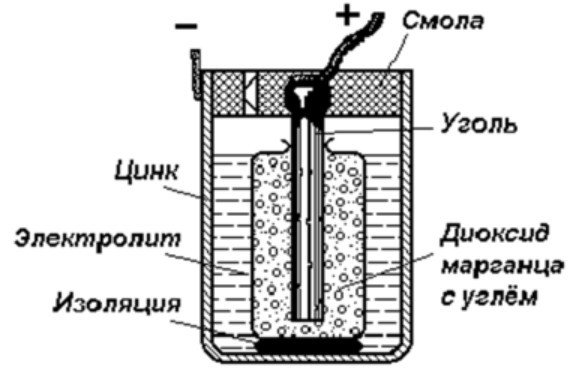
L'estructura d'una cel·la galvànica
El dispositiu d'emmagatzematge d'energia més simple consisteix en:
- Barra de carbó.
- Dos metalls diferents.
- Electròlit.
- Resina o plàstic.
- Aïllant.
Com es pot veure en aquest diagrama, una cel·la galvànica consta d'un elèctrode negatiu i un de positiu. Poden estar fetes de coure, zinc o altres metalls. S'anomenen cel·les de coure-zinc. De vegades s'anomenen piles seques.
Designació d'una cel·la galvànica en un diagrama Està fet en forma de dues línies verticals, properes entre si a una petita distància. Una d'elles serà més petita. A les vores de cadascuna d'aquestes línies hi ha senyals que indiquen polaritatLa línia llarga està marcada com a positiva i la línia curta com a negativa. El voltatge es pot mostrar al costat. Això significa que el circuit que utilitza la bateria funciona només a aquest voltatge.
El principi de funcionament d'una cèl·lula galvànica
Una cel·la galvànica funciona mitjançant el moviment d'electrons d'un contacte metàl·lic a un altre. Es produeix una transformació química. Més informació sobre la termodinàmica d'una cel·la galvànica i la formació d'electricitat galvànica. Aquí.
Respostes a preguntes freqüents
| Galvànic | Explicació |
| Bateria | Una font d'energia que funciona mitjançant processos que tenen lloc dins d'un espai confinat i en miniatura. Concretament, l'energia es genera mitjançant una reacció química. |
| Pila voltaica o pila voltaica | Aquest és un element energètic creat per primera vegada per un científic anomenat Volt. |
| Procés | La interacció entre elements químics que dóna lloc a la formació d'un corrent elèctric. |
| Descàrrega | Això és la finalització d'una reacció química. És a dir, no hi haurà interacció entre substàncies. La descàrrega galvànica és present a Warframe. Essencialment, és una modificació que escasseja. S'utilitza per a armes de cos a cos. PolaritatV2. |
| contacte galvànic | Aquest és el contacte entre els elèctrodes i la solució. |
| Efecte | L'aparició d'una diferència entre dos contactes fets de dos tipus de metall. La magnitud depèn de la temperatura i la composició química dels conductors. Essencialment, aquesta és la primera llei de Volta. |
| Connexió/enllaç/cadena | Connectar dues o més seccions d'un circuit elèctric a una font de corrent. |
| càrrega galvànica | Omplint la bateria d'energia. |
La galvanització és un procés químic que utilitza corrent elèctric. La reacció redueix la quantitat de cations metàl·lics dissolts fins al punt que finalment formen una capa uniforme sobre un elèctrode metàl·lic. Com a resultat, l'element esdevé més durador, les petites abolladures desapareixen i el seu aspecte esdevé més atractiu.
Tipus de cèl·lules galvàniques
Hi ha diversos tipus específics de bateries.
Taula de cel·les galvàniques
| Tipus | Voltatge | Principals avantatges |
| Liti | 3 V | Gran capacitat, corrent elevat. |
| Bateries de sal o carboni-zinc | 1,5 polzades | El més barat. |
| Oxihidroxil de níquel NiOOH | 1,6 volts | Alt corrent. Alta capacitat. |
| Alcalí o alcalina | 1,6 V | Corrent alt. Bon volum. |
Aquest tema es tracta amb més detall a l'article. tipus de bateries!
Propòsit d'una cèl·lula galvànica
Està dissenyat per engegar equips elèctrics. Aquests poden incloure:
- Vigila.
- Comandaments a distància.
- Llanternes.
- Equipament mèdic.
- Ordinadors portàtils.
- Joguines.
- Clauers.
- Telèfons.
- Punters làser.
- Calculadores.
I coses semblants al nostre voltant.
Cèl·lula galvànica a casa
Pots fer una font d'energia senzilla tu mateix. Per fer-ho, necessitaràs els materials següents:
- Tassa de plàstic.
- Electròlit. Pot ser una solució salina, sosa o àcid cítric diluït en aigua.
- Plaques de dos metalls diferents. Per exemple, alumini i coure.
- Cables
procés de fabricació
Agafeu un recipient de plàstic i aboqueu-hi l'electròlit. No l'ompliu fins a la vora; és millor deixar-lo curt d'1 a 2 centímetres. Connecteu els cables a les plaques metàl·liques. A continuació, col·loqueu les plaques de coure i alumini a les vores del recipient. Han de ser paral·leles entre si. Un cop tot estigui a punt, podeu mesurar el voltatge amb un voltímetre.
Connecteu el dispositiu i toqueu les sondes als contactes de la nostra font d'alimentació. Mantingueu-les al seu lloc fins que la pantalla mostri voltatge. Normalment, és de 0,5-0,7 volts. Aquests valors depenen de l'electròlit o, més precisament, de la substància utilitzada com a electròlit.
Així és com es fa una cel·la galvànica casolana.